العدد الكتلي هو مجموع
جدول المحتويات
العدد الكتلي هو مجموع
العدد الكتلي هو مجموع عددين يمثلان مكونين من مكونات الذرة، حيث تتكون الذرة من الالكترونات والنيوترونات والبروتونات، وتتميز كل ذرة بعددها الكتلي وعددها الذري الذين يميزانها عن غيرها من الذرات، سيبين المقال مفهوم العدد الكتلي والعدد الذري والكتلة الذرية والفروقات بينهما.
نظرة عامة حول العدد الكتلي
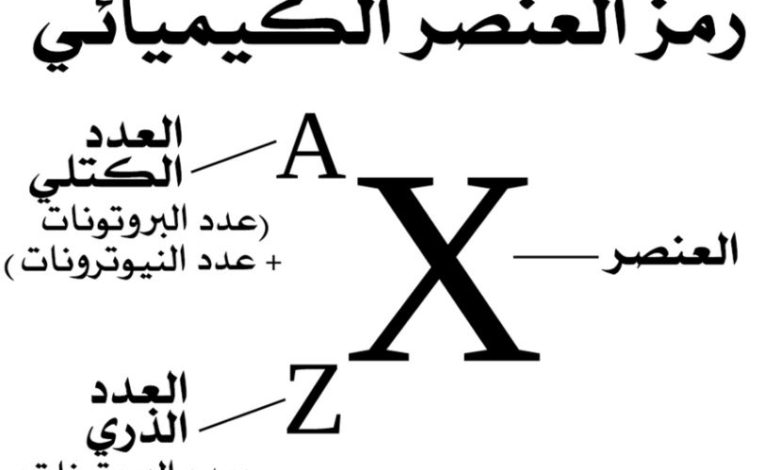
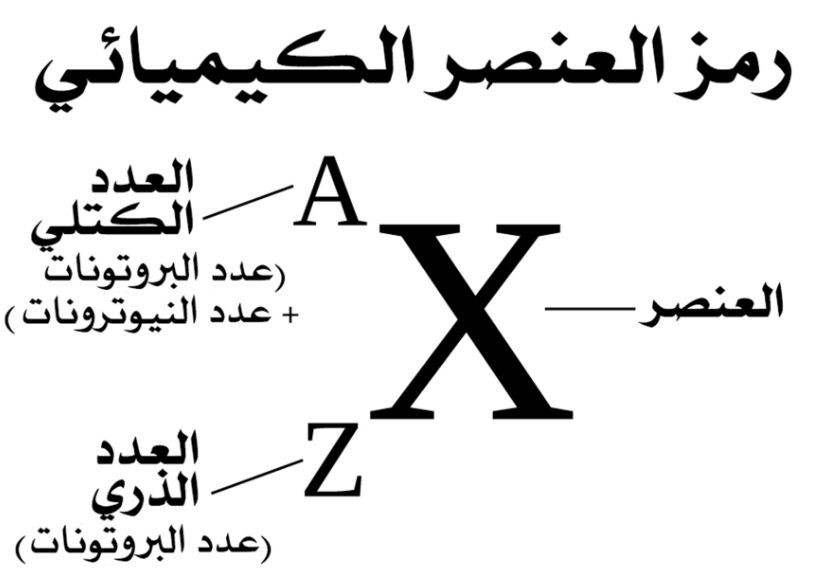
إن العدد الكتلي هو عددٌ صحيحٌ يساوي مجموع عدد البروتونات والنيوترونات لنواة الذرة، وبمعنى آخر، هو مجموع عدد النكليونات في الذرة، وتُستثنى الإلكترونات من العدد الكتلي لأن كتلتها أصغر بكثير من كتلة البروتونات والنيوترونات بحيث لا تؤثر حقًا على قيمة الكتلة، ويتم الإشارة إلى الرقم الكتلي باستخدام الحرف الكبير A، ويجب التمييز بين العدد الكتلي والعدد الذري لأنهما مفهومان مختلفان.
العدد الكتلي هو مجموع
إن الإجابة عن هذا السؤال هي: العدد الكتلي هو مجموع عدد البروتونات والنيوترونات، فلحساب العدد الكتلي لأي عنصر كيميائي يجب إيجاد مجموع عدد البروتونات والنيوترونات التي تحويها الذرة، ويجب الانتباه إلى استثناء عدد الالكترونات من العدد الكتلي، لأن كتلتها صغيرة جداً مقارنة بكتلة النيوترونات والبروتونات.
حساب العدد الكتلي
العدد الكتلي للذرة يساوي العدد الإجمالي للبروتونات والنيوترونات الموجودة في نواتها، ويمكن تمثيل هذا التعريف في معادلة، كما هو موضح أدناه:
العدد الكتلي = عدد البروتونات في نواة الذرة + عدد النيوترونات في نواة الذرة
فالكتلة الحقيقية للذرة هي كمية صغيرة بشكل لا يصدق، ولتبسيط القيم العددية المستخدمة، يتم تعيين كتلة بروتون واحد بقيمة 1 وحدة كتلة ذرية، أو (Atomic Mass Unit) amu، ونظرًا لأن كتلة النيوترون تساوي تقريبًا كتلة البروتون، فإن كل نيوترون موجود يُعطى أيضًا قيمة 1 amu، ونظرًا لأن كتلة الإلكترون تساوي 1 /2000 من كتلة البروتون، فإن أي مساهمة تقّدمها الإلكترونات للكتلة الإجمالية للذرة لا تكاد تذكر، ولذلك، يتم تجاهل عدد الإلكترونات الموجودة في الذرة عند حساب العدد الكتلي لتلك الذرة.
مثال عن حساب العدد الكتلي
استخدم الجدول الدوري لحساب العدد الكتلي لذرة الهيدروجين التي تحتوي على 2 نيوترون.
الحل: يتم حساب العدد الكتلي عن طريق جمع عدد البروتونات والنيوترونات الموجودة داخل تلك الذرة، وعدد النيوترونات معطى، ولكن يجب تحديد عدد البروتونات من العدد الذري للعنصر، وفي هذه الحالة، يحتوي الهيدروجين (H) على عدد ذري قدره 1، أي أن كل ذرة هيدروجين تحتوي على بروتون واحد، يمكن بعد ذلك تطبيق المعادلة الموضحة أعلاه، على النحو التالي:
العدد الكتلي لذرة الهيدروجين = 1 + 2
وبالتالي سيكون العدد الكتلي لذرة الهيدروجين = 3.
الفرق بين العدد الكتلي والكتلة الذرية
تحتوي الذرات المحايدة لكل عنصر على عدد متساوٍ من البروتونات والإلكترونات، ويحدد عدد البروتونات العدد الذري للعنصر ويستخدم لتمييز عنصر عن الآخر، إلا أن عدد النيوترونات متغيرٌ للعنصر، مما ينتج نظائر العنصر، وهي أشكال مختلفة من نفس الذرة والتي تختلف فقط في عدد النيوترونات التي تمتلكها، ويحدد عدد البروتونات وعدد النيوترونات معًا العدد الكتلي للعنصر، ونظرًا لأن نظائر عنصر ما لها أعداد كتلية مختلفة قليلاً، فيتم حساب الكتلة الذرية عن طريق الحصول على متوسط الأعداد الكتلية لنظائرها، وبالتالي يمكن القول أن:
- الكتلة الذرية: هي متوسط الأعداد الكتلية للذرة، مع مراعاة جميع نظائرها الطبيعية.
- العدد الكتلي: مجموع عدد البروتونات وعدد النيوترونات في الذرة، ونرمز له بالرمزA .
- العدد الذري: عدد البروتونات في الذرة ونرمز له بالرمز Z، على سبيل المثال، العدد الذري للكربون (Z) هو 6 لأنه يحتوي على 6 بروتونات.
وهنا يصل المقال إلى ختامه بعد أوضح أنّ العدد الكتلي هو مجموع النيوترونات والبروتونات الموجودة في نواة الذرة، كما بيّن المقال كيفية حساب العدد الكتلي والفرق بينه وبين العدد الذري والكتلة الذرية.
فضلا لا أمرا إدعمنا بمتابعة 😉
👇👇👇
https://t.me/eduschool40
العدد الكتلي هو مجموع – مدونة المناهج السعودية



